생성형 AI를 활용한 의료기기의 안전성·유효성 평가, 제품화 지원 도움
작년 3월부터 협의체 구성 후 논의, 개발 과정에서 고려해야 할 사항 마련
식품의약품안전처(식약처)가 '생성형 인공지능(AI) 의료기기 허가·심사 가이드라인'을 24일 제정·발간한다. 이는 생성형 AI를 활용한 의료기기의 안전성·유효성 평가에 도움을 주고 제품화를 지원하기 위함이다.
식약처는 지난해 3월부터 학계·의료계·산업계 전문가와 협의체를 구성하고 생성형 AI 관련 최신 기술·규제 동향을 조사후 논의했다고 밝혔다.
이를 바탕으로 생성형 AI 의료기기 개발부터 허가 후 관리까지의 과정에서 위험요인을 분석하고 허가 심사 시 고려해야 할 사항을 마련했다.
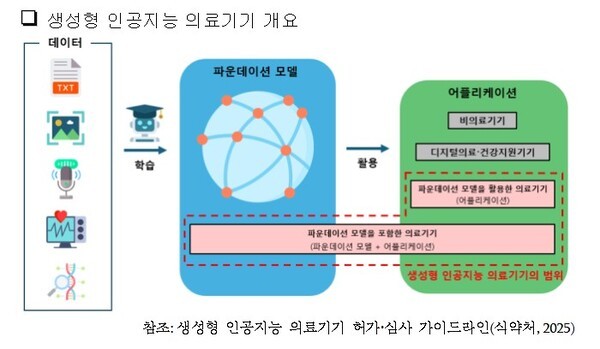
식약처는 생셩형 AI는 의료영상 판독·진단 보조·치료 계획 수립 등 다양한 영역에서 활용될 수 있지만 데이터 편향·정확성 부족·윤리적 문제 등이 제기될 우려가 있다고 설명했다. 그렇기 때문에 AI를 활용한 의료기기의 경우 이를 고려해 안정성·유효성을 평가해야 한다.
이번 가이드라인에서는 생성형 AI 의료기기에 해당하는 사례를 제시하고 허가신청서 작성 방법 및 제출자료에 대해 안내했다. 주요 내용은 ▲생성형 AI 의료기기 관리범위 명확화 ▲생성형 AI 의료기기 예시 ▲생성형 AI 의료기기 위험관리 등이다.
오유경 식품의약품안전처장은 "이번 가이드라인이 국내 AI 활용 의료기기 개발에 도움을 줄 것으로 기대한다"며 "식약처는 앞으로도 선제적이고 투명한 규제 체계를 마련하는 동시에 국내 기업이 글로벌 시장에서 경쟁력을 확보할 수 있도록 국제 규제 조화를 위한 규제외교도 적극 추진해 나갈 계획이다"고 강조했다.
관련기사

