삼성바이오에피스·셀트리온 등 바이오시밀러 임상 간소화에 적극적
이재명 대통령 "바이오 시밀러 처방 시 인센티브 제공"

| 스마트에프엔 = 양대규 기자 | 글로벌 바이오시밀러 시장의 규제 패러다임이 '임상 3상 생략'이라는 거대한 전환점을 맞이하면서, 세계적 경쟁력을 갖춘 한국 바이오 업계와 규제 당국이 관련 정책을 추진하기 위해 적극적인 움직임을 보이고 있다.
삼성바이오에피스와 셀트리온 등 국내 바이오시밀러 업계 리더들은 과학적 당위성과 환자 접근성을 내세워 속도감 있는 변화를 촉구했다. 이에 한국 정부도 글로벌 동향을 주시하면서 적극적인 지지를 보이고 있다.
최근에는 이재명 대통령이 직접 나서 "부조리"를 언급하며 제도 개선을 지시하기도 했으며 식품의약품안전처도 이에 긍정적인 답을 내놓았다.
삼성바이오에피스·셀트리온 등 바이오시밀러 임상 간소화에 적극적
8일 업계에 따르면 바이오시밀러 임상 3상 규제 완화 논의의 선봉에는 삼성바이오에피스가 있다. 질리언 울렛 삼성바이오에피스 미국 규제정책 전략 담당 상무는 지난 4일 열린 '글로벌 바이오 컨퍼런스 2025'에서 "과학은 질문을 받았고 답을 했습니다"라며 비교 임상 효능연구(CES)가 더 이상 불필요하다고 주장했다.
CES는 2개 이상의 치료제의 임상적 효능 등을 비교해 치료제 간 효과, 안전성 등이 비슷한지 평가하는 대규모 임상 연구로 임상 3상을 의미한다.
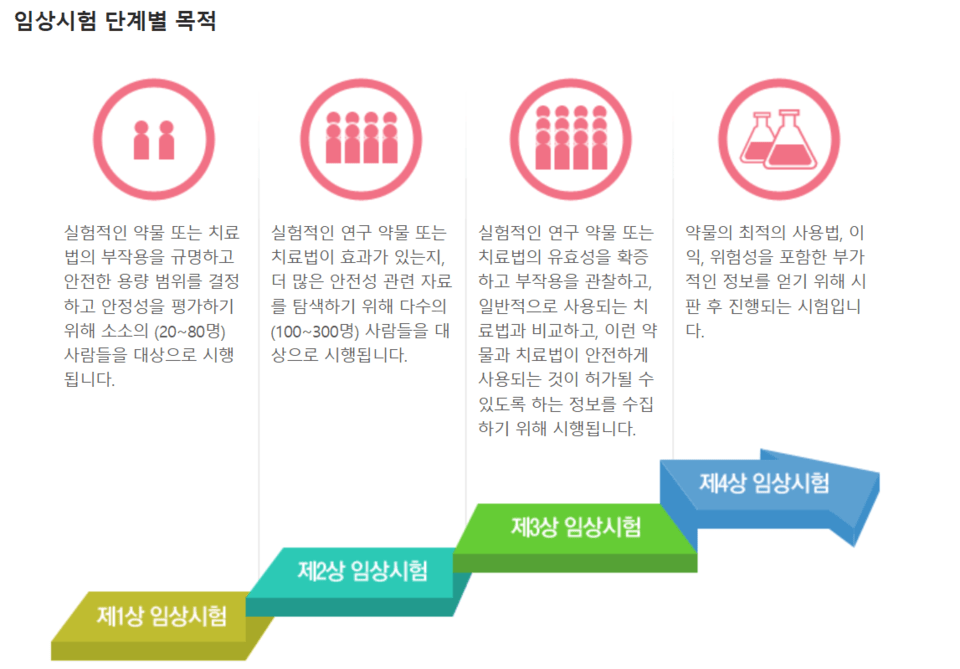
울렛 상무는 "수십 년간의 경험을 볼 때 새로운 정보를 주지 못하는 CES는 과학적으로 중복될 뿐"이라며, 약동학(PK), 품질, 면역원성 데이터만으로 허가에 충분하다고 말했다. 이어 "불필요한 규제로 개발 비용과 시간이 늘어나면서 신규 바이오시밀러의 시장 진입이 늦어지고, 이는 궁극적으로 환자의 접근성을 저해한다"고 지적했다. 제네릭(화학합성의약품)보다 100배나 많은 비용이 드는 현재의 개발 모델은 지속 불가능하다는 것이다.
이어 김경아 삼성바이오에피스 대표도 5일 인천 송도 컨벤시아에서 열린 ‘바이오 혁신 토론회’에 참석해 "국내 바이오시밀러 보급률은 미국, 유럽, 일본에 비해 낮고 속도도 더디다"며 "정부의 장려정책이 부족한 것이 원인"이라고 지적했다. 김 대표는 해외 주요국처럼 바이오시밀러 사용을 장려하기 위해 "처방 의사에게 인센티브를 주는 방식이 필요하다"고 구체적인 정책 대안을 정부에 요구했다. 임상 간소화라는 규제 개혁을 넘어, 승인 이후의 시장 수용성을 높이는 것도 중요한 과제라는 것이다.
삼성바이오에피스와 함께 셀트리온도 글로벌 규제 완화 흐름의 핵심 수혜자로 꼽힌다. 서정진 셀트리온 회장은 지난 5월 간담회에서 미국과 유럽 내 바이오시밀러 인허가 간소화 움직임에 대해 "임상 1상 데이만으로 제품을 판단하겠다는 것은 임상 1상에서 오리지널 약과의 동등성, 유효성, 안전성을 모두 보겠다는 말"이라며 "셀트리온과 같이 연구개발(R&D) 실력이 있고 자체 생산 능력이 있는 회사들에게 더 큰 이익으로 다가올 것"이라고 강조했다.

이재명 대통령 "바이오 시밀러 처방 시 인센티브 제공"
업계의 강력한 요구에 정부도 적극적으로 응답하는 중이다. 이재명 대통령은 '바이오 혁신 토론회'에 참석해 "약효가 동일한데도 오리지널 의약품만 처방하는 것은 오래된 논쟁거리이자 일종의 부조리"라고 강하게 비판했다. 이 대통령은 가격 경쟁력 있는 바이오시밀러 처방 시 의사에게 인센티브를 제공하는 방안을 검토하라고 보건복지부에 직접 지시하며, 의료 재정 효율화를 위한 신속한 제도 정비를 주문했다.
같은날 오유경 식약처장도 바이오시밀러 임상 3상 자료 간소화를 논의하기 위한 민관협의체 발족을 발표하며 소통 의지를 분명히 했다. 오유경 식약처장은 “바이오시밀러 임상 3상은 시간과 비용이 막대하다”며 “미국·유럽 규제기관과 실무 협의를 진행 중이고, 안전성 문제가 없는 범위 내에서 임상 3상 심사 자료를 간소화하는 방안을 검토하겠다”고 말했다.
또한 미국 FDA와 협력해 바이오시밀러 임상 간소화를 위한 새로운 국제의약품규제조화위원회(ICH) 가이드라인 제정에 참여하는 등 장기적인 관점에서 글로벌 표준과 보조를 맞추겠다는 계획이다.
바이오시밀러 임상 3상 생략은 한국 뿐만 아니라 전 세계적으로 거스를 수 없는 대세가 되고 있다. 유럽의약품청(EMA), 미국 FDA, 캐나다 보건부, 영국의 의약품 및 보건의료제품규제청(MHRA) 등은 2021년에서 2025년 사이 임상 3상 생략과 유사한 정책을 추진하고 있다.
업계는 과학적 근거와 경제적 논리를 바탕으로 과감한 규제 혁신을 요구하고 있으며, 대통령실 또한 의료 재정 건전성 확보 차원에서 힘을 싣는 상황이다. 이제 공은 식약처가 주도하는 민관협의체로 넘어갔다.
- 정부, 'K-바이오 의약산업 대도약 전략' 발표···글로벌 5위 바이오 강국 목표
- 셀트리온, 안과질환 치료제 ‘아이덴젤트’ 52주 임상 결과 국제학술지 게재
- 글로벌 CDMO 리더십 확보를 위해 삼성바이오로직스 거침없이 '질주'
- 동아ST, 스텔라라 바이오시밀러 ‘이뮬도사’ 美 출시
- 셀트리온홀딩스, 5000억원 규모 셀트리온 주식 매입
- 롯데바이오로직스, 송도 바이오캠퍼스 제1공장 상량식
- 셀트리온, '일자리 으뜸기업’ 선정··· 2년 연속 양질 일자리 창출
- 셀트리온, 바이오 헬스 아카데미 프로그램 ‘셀온’ 1기 모집
- 삼성바이오로직스, BPI 참가···CDMO 경쟁력 강조
- 지씨씨엘, 프론티어와 글로벌 임상시험 시장 공략 위한 MOU 체결
- 삼성바이오로직스, 인적분할 주총 통과···다음달 1일 '삼성바이오에피스' 분할

